II аналитическая группа: Ag+, Hg2+ ,Pb2+
Групповой реагент (водный раствор хлороводородной кислоты) осаждает из водных растворов катионы второй аналитической группы в виде осадков малорастворимых в воде хлоридов серебра AgCl, ртути Hg2Cl2 и свинца PbCl2. Произведения растворимости этих трех хлоридов при комнатной температуре равны соответственно 1,78 10-10, 1,3 10-18, 1,6 10-5. Хлорид свинца заметно растворим в воде, особенно - при нагревании. Растворимость хлорида свинца в воде составляет (г/100 г воды): 0,99 при 25 °C и 2,62 при 80 °C. При действии группового реагента катионы свинца осаждаются из водного раствора неполностью - частично они остаются в растворе.
Ко второй аналитической группе катионов относятся ионы Ba2+, Sr2+ и Ca2+. Это S2-элементы второй группы периодической системы Д.И.Менделеева. Степень окисления у этих элементов постоянна и равна +2, они имеют устойчивые оболочки типа инертного газа. По сравнению с катионами S1-элементов их заряд больше, а радиусы меньше, что приводит к проявлению ими больших поляризующих свойств. Вследствие этого, катионы бария, стронция и кальция дают ряд малорастворимых соединений с многозарядными анионами — сульфатами, карбонатами, фосфатами и оксалатами.
В ходе анализа катионы второй группы должны быть отделены от катионов первой аналитической группы, так как катионы второй группы мешают определению магния. Наиболее приемлемо их осаждение в виде карбонатов, что дает возможность практически полного отделения катионов II группы от первой. При этом полученный осадок карбонатов легко растворяется даже в уксусной кислоте, а избыток осаждающих CO32--ионов может быть удален из раствора при его подкислении вследствие разложения угольной кислоты, чего невозможно достичь при использовании для осаждения сульфатных, оксалатных и фосфатных ионов.
Аналитические реакции катионов серебра Ag+
Катионы серебра образуют осадки со многими реагентами. Для открытия катионов Ag+ чаще всего используют осадительные реакции с анионами Cl- ,Br- ,I- ,CrO42-, а также окислительно-восстановительную реакцию, например, с формальдегидом HCHO (реакция «серебряного зеркала»).
Реакция с растворимыми хлоридами (фармакопейная), бромидами и йодидами. Катионы Ag+ при взаимодействии с растворимыми хлоридами, бромидами и йодидами образуют соответственно осадки: белый - хлорида серебра AgCl, желтоватый - бромида серебра AgBr и желтый - йодида серебра AgI:
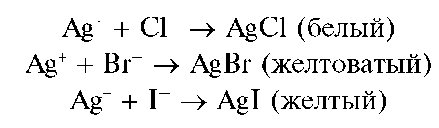
Осадок хлорида серебра растворяется в концентрированном аммиаке с образованием комплекса [Ag(NH3)2]Cl:
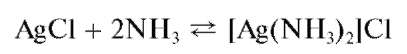
При подкислении раствора этого комплекса снова выпадает осадок
AgCl: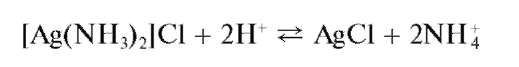
При прибавлении к раствору комплекса раствора йодида калия KI образуется осадок йодида серебра AgI:
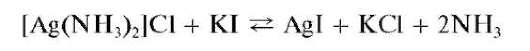
Осадок AgCl растворяется также в концентрированных растворах HO и хлоридов, в присутствии цианида калия KCN, тиосульфата натрия Na2S2O3 с образованием растворимых комплексов:
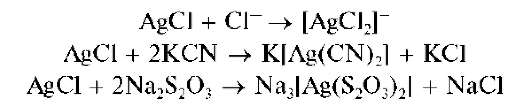
Осадок AgBr малорастворим, а AgI - нерастворим в концентрированном аммиаке.
Открытию катионов Ag+ реакцией с хлорид-ионами мешают катионы Cu+,Au+,Tl+,Pb2+, Hg2+, также образующие малорастворимые осадки хлоридов.
Методика. В одну пробирку вносят 2-3 капли раствора NaCl, в другую - столько же капель раствора NaBr, в третью - столько же раствора KI. В каждую пробирку добавляют по 3-5 капель раствора нитрата серебра AgNO3 Наблюдается помутнение растворов и выпадение осадков AgCl, AgBr и AgI.
Испытывают растворимость осадков, прибавляя в каждую пробирку по 5-10 капель концентрированного аммиака. При этом осадок AgCl растворяется полностью, осадок AgBr - частично, осадок AgI - не растворяется.
Раствор [Ag(NH3)2]Cl из первой пробирки делят на две примерно равные части. В одну из них прибавляют несколько капель раствора HNO3, в другую - несколько капель раствора KI. Наблюдается выпадение осадков AgCl и AgI соответственно.
Реакция с хромат-ионами CrO42-. При взаимодействии катионов Ag+ c хромат-ионами в нейтральной среде (рН = 6,5-7,5) выделяется осадок хромата серебра Ag2CrO4 кирпично-красного цвета:
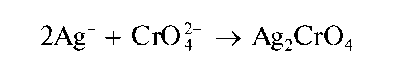
Осадок растворим в растворах кислот. В концентрированном аммиаке растворяется с образованием аммиачного комплекса серебра:
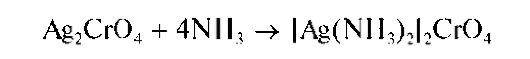
Если реакцию между Ag+ иCrO42- проводить в щелочной среде, то вместо хромата серебра выпадает осадок оксида серебра Ag2O. В уксуснокислой среде образуется дихромат серебра Ag2Cr2O7 красно-бурого цвета.
Мешают все катионы, образующие малорастворимые хроматы (Sr2+, Ba2+, Hg2+ ,Hg2+,Pb2+,Bi3+ идр.).
Методика. В пробирку вносят 2-3 капли раствора нитрата серебра AgNO3, прибавляют 1-2 капли раствора хромата калия K2CrO4 Выпадает кирпично-красный осадок.
Реакция с формальдегидом HCHO - реакция «серебряного зеркала» (фармакопейная). В присутствии в растворах восстановителей катионы Ag+ восстанавливаются до металлического серебра, которое, осаждаясь на стенках чистойпробирки, образует тонкую блестящую пленку - «серебряное зеркало». В качестве восстановителя часто применяют разбавленный раствор формальдегида в аммиачной среде при слабом нагревании (при сильном нагревании металлическое серебро выделяется в виде черно-бурого осадка). Вначале при реакции катионов Ag+ с
аммиаком образуется гидроксид серебра AgOH, переходящий в черно-бурый оксид серебра Ag2O, который растворяется в избытке аммиака с образованием аммиачного комплекса [Ag(NH3)2]+. Этот комплекс при взаимодействии с формальдегидом дает металлическое серебро. Реакцию можно описать схемой:
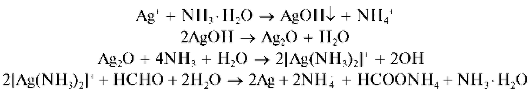
Мешают катионы ртути Hg2+,Hg22+.
Методика. Вчистую, тщательно промытую (раствором хромовой смеси, а затем дистиллированной водой) пробирку вносят 3-4 капли раствора AgNO3, прибавляют несколько капель раствора аммиака до растворения выпавшего осадка оксида серебра Ag2O, несколько капель разбавленного раствора формальдегида и слегка нагревают пробирку (избегать сильного нагревания!). Стенки пробирки покрываются тонкой блестящей зеркальной пленкой металлического серебра.
Другие реакции катионов серебра. При взаимодействии катионов Ag+ с сероводородом H2S или растворимыми сульфидами образуется черно-коричневый осадок сульфида серебра Ag2S; с щелочами - черный осадок оксида серебра Ag2O; с тиоцианатом калия KSCN и с другими растворимыми тиоцианатами - белый осадок тиоцианата серебра AgSCN, растворимый в избытке реагента; с тиосульфатом натрия Na2S2O3 - белый осадок тиосульфата серебра Ag2S2O3, растворимый в избытке реактива; с гидрофосфатом натрия Na2HPO4 - желтый осадок фосфата (ортофосфата) серебра Ag3PO4; с ферроцианидом K4[Fe(CN)6] и феррицианидом K3[Fe(CN)6] калия - белый осадок Ag4[Fe(CN)6] кирпично-красный осадок Ag3[Fe(CN)6] соответственно. С дитизоном катионы Ag+ образуют окрашенные комплексы. Известны и другие реакции катионов серебра.
Аналитические реакции катиона ртути(I) Hg2+
ВНИМАНИЕ! Соединения ртути очень токсичны! Работать осторожно!
Реакция с хлорид-ионами. Катионы Hg22+ при взаимодействии с хлорид-ионами Cl- в растворах образуют белый осадок каломели Hg2Cl2: 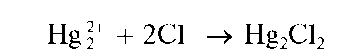
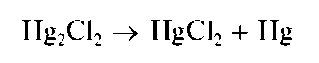
На свету осадок постепенно чернеет с выделением тонкодисперсной металлической ртути:
Осадок не растворяется в разбавленной, но растворяется в концентрированной азотной кислоте:
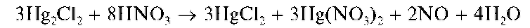
При прибавлении к осадку каломели раствора аммиака он темнеет вследствие выделения тонкодисперсной металлической ртути:
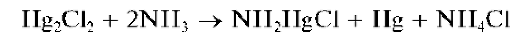
Реакции образования каломели и ее взаимодействие с аммиаком используются при дробном открытии ртути(I).
Методика. В пробирку вносят ~5 капель раствора нитрата ртути(I) Hg2(NO3)2 и прибавляют такое же количество раствора хлорида натрия. Выпадает белый осадок каломели. Осадок разделяют на две части. К одной части прибавляют концентрированную азотную кислоту - осадок растворяется. К другой части прибавляют несколько капель раствора аммиака - осадок чернеет.
Восстановление Hg2+ до металлической ртути хлоридом олова(П). Катионы ртути(I) при реакциях с восстановителями дают металлическую ртуть.
Так, при реакции Hg2+ с хлоридом олова(II) выделяющийся вначале белый осадок каломели Hg2Cl2 постепенно чернеет вследствие образования тонкодисперсной металлической ртути при восстановлении Hg2+ оловом(II):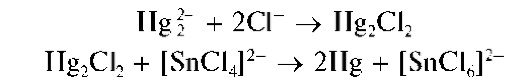
Мешают катионы ртути(II) Hg2+, также восстанавливающиеся до металлической ртути.
Методика. В пробирку вносят ~2 капли раствора нитрата ртути(I) Hg2(NO3)^ прибавляют ~2 капли раствора хлорида олова(II). Выпадает белый осадок каломели, постепенно чернеющий за счет выделения металлической ртути.
Восстановление Hg2+ металлической медью. Катионы Hg2+ восстанавливаются металлической медью до металлической ртути, образующей с медью амальгаму меди:
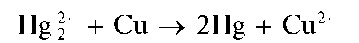
Мешают катионы ртути(II) Hg2+, дающие такой же эффект.
При нагревании ртуть улетучивается (отличие от аналогичной реакции с солями серебра).
Методика. На свежеочищенную (промытую раствором аммиака и затем дистиллированной водой или протертую наждаком) медную поверхность (например, на медную монету) наносят каплю раствора Hg2(NO3)2 Через некоторое время на поверхности образуется серое пятно амальгамы меди, которое после протирания поверхности мягкой тканью или сухой фильтровальной бумагой становится блестящим.
Если медную монету полностью погрузить в раствор Hg2(NO3)2 затем, после извлечения из раствора, через некоторое время протереть мягкой тканью или сухой фильтровальной бумагой, то вся монета становится блестящей.
Реакция с водным раствором аммиака. Катионы Hg22+ реагируют с аммиаком в водном растворе с образованием черного осадка, представляющего собой смесь тонкодисперсной металлической ртути и соли, содержащей катион [OHg2NH2]NO3Если в качестве соединения ртути(1) использовать нитрат Hg2(NO3)2, то реакцию можно описать схемой:
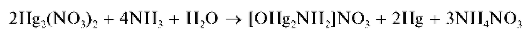
Методика. В пробирку вносят 2-3 капли раствора нитрата ртути(I) Hg2(NO3)2 и прибавляют ~5 капель раствора аммиака. Выпадает черный осадок.
Реакция с йодидами. Катионы Hg22+ образуют при взаимодействии с йодид-ионами 1-зеленый осадок йодида ртути(1) Hg2I2, растворимый в избытке реактива с образованием бесцветного комплексного тетрайодомеркурат(II)-иона [HgI4]2- черного осадка тонкодисперсной металлической ртути:
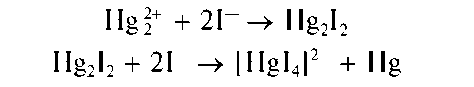
Методика. В пробирку вносят 3-4 капли раствора Hg2(NO3)2 ипри-бавляют одну каплю раствора йодида калия KI. Выпадает осадок Hg2I2. Добавляют избыток (~5-10 капель) раствора KI. На дне пробирки под бесцветным раствором остается черный осадок металлической ртути.
Реакция с хромат-ионами. Катионы Hg2+ образуют с хромат-ионами CrO42- кирпично-красный осадок хромата ртути(I) Hg2CrO4: 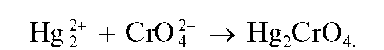
Мешают все катионы, образующие малорастворимые хроматы (Sr2+, Ba2+,Pb2+ идр.).
Методика. В пробирку вносят 3-4 капли раствора Hg2(NO3)2,при-бавляют 1-2 капли раствора хромата калия K2CrO4Выпадает красный осадок хромата ртутив).
Реакция с щелочами. Щелочи (NaOH, KOH) выделяют из растворов, содержащих катионы Hg2+, черный осадок оксида ртутив) Hg2O:
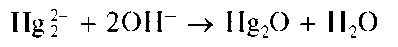
Осадок растворяется в азотной и концентрированной уксусной кислотах.
Методика. В пробирку вносят 3-4 капли раствора Hg2(NO3)2 ипри-бавляют 2-3 капли раствора NaOH или KOH. Выделяется черный осадок оксида ртути).
Другие реакции катионов ртути. Катионы Hg2+ образуют осадки при реакциях: с сульфид-ионами S2-- черный HgS + Hg; с иодат-ионами IO3- - желтый Hg2(IO3)2; с оксалат-ионами C2O42- - белый Hg2C2O4; с фосфат-ионами - белый (Hg2)3(PO4)2; с карбонат-ионами - желтый Hg2CO3 (быстро темнеющий вследствие разложения по схеме: Hg2CO3 -> HgO + Hg + CO2); с K4[Fe(CN)6] и K3[Fe(CN)6] - соответственно бледно-желтый и желто-зеленый ферро- и феррицианиды ртути.
С дифенилкарбазидом катионы Hg224 образуют комплексы синего цвета.
Аналитические реакции катиона свинца Pb2+
ВНИМАНИЕ! Соединения свинца токсичны! Работать осторожно!
Известно значительное число реакций катионов свинца с различными соединениями, при которых образуются осадки или окрашенные продукты взаимодействия.
Реакция с хлорид-ионами. Катионы свинца образуют с хлорид-ионами (при рН<7) белый осадок хлорида свинца PbCl2:
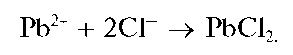
Хлорид свинца заметно растворим в воде, особенно при нагревании, поэтому катионы Pb2+ осаждаются из растворов хлорид-ионами неполностью.
Осадок хлорида свинца растворяется в горячей воде; при охлаждении раствора из него снова выпадает хлорид свинца, но уже в форме игл.
Из разбавленных щелочных растворов выпадает осадок гидроксида свинца; из концентрированных щелочных растворов осадок хлорида свинца не выпадает.
Методика. В пробирку вносят 3-4 капли раствора нитрата свинца Pb(NO3)2, прибавляют 3-4 капли раствора хлорида натрия. Выпадает белый осадок хлорида свинца.
К полученной смеси приливают ~1,5 мл дистиллированной воды и нагревают до растворения осадка. При охлаждении раствора из него снова выпадает осадок хлорида свинца в виде игл.
Реакция с йодид-ионами (фармакопейная). Катионы свинца при взаимодействии в растворах с йодид-ионами I- образуют желтый осадок йодида свинца, растворимый в избытке реактива с образованием тетрайодоплюмбат(II)-ионов [PbI4]2-.
Pb2+ + 2I- -> PbI2 PbI2 + 2I- -> [PbI4]2-
Осадок йодида свинца растворяется при нагревании в воде, в растворе уксусной кислоты. При охлаждении раствора из него снова выпадают красивые золотисто-желтые кристаллы йодида свинца (реакция «золотого дождя»). Мешают катионы Cu2+,Ag+, Hg22+ ,Hg2+,Bi3+,Fe3+.
Методика. В пробирку вносят 3-5 капель раствора нитрата свинца Pb(NO3)2, прибавляют 3 капли раствора йодида калия KI. Выпадает желтый осадок йодида свинца.
К смеси прибавляют несколько капель воды, подкисленной уксусной кислотой, и нагревают до полного растворения осадка. При медленном охлаждении пробирки (ее погружают в холодную воду или оставляют остывать на воздухе) выпадают красивые блестящие золотисто-желтые чешуйчатые кристаллы йодида свинца.
Реакция с хромат-ионами и дихромат-ионами. Катионы свинца образуют с хромат-ионами CrO42- и дихромат-ионами Cr2O72- в уксуснокислой среде желтый кристаллический осадок хромата свинца PbCrO4:
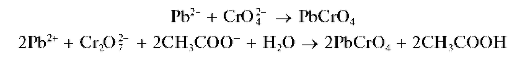
Осадок хромата свинца не растворяется в уксусной и разбавленной азотной кислотах, в водном аммиаке, но растворяется в щелочах с образованием комплексов [Pb(OH)4]2-: 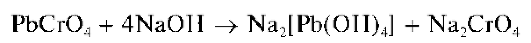
Мешают катионы, образующие нерастворимые хроматы (Ba2+,Hg2+, Bi3+ идр.).
Методика. В пробирку вносят 2-3 капли раствора Pb(NO3)2,2-3 капли раствора ацетата натрия и ~3 капли раствора хромата K2CrO4 или дихромата K2Cr2O7 калия. Выпадает желтый кристаллический осадок хромата свинца.
Реакция с сульфат-ионами. Катионы Pb2+ при взаимодействии в растворе с сульфат-ионами SO42- образуют белый осадок сульфата свинца PbSO4: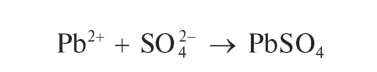
Осадок растворяется при нагревании в щелочах (в отличие от осадков сульфатов кальция, стронция и бария):
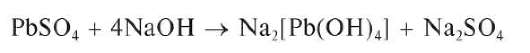
Растворяется также в концентрированной серной кислоте:
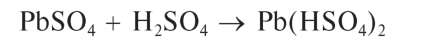
Растворяется в 30 % растворе ацетата аммония:
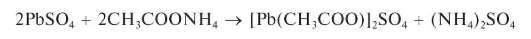
Открытию катионов свинца в виде сульфата свинца мешают катионы, образующие малорастворимые сульфаты (Ca2+,Sr2+,Ba2+, Hg2+ и др.).
Методика. В пробирку вносят 5 капель раствора Pb(NO3)2,прибав-ляют столько же капель раствора сульфата натрия или калия. Выпадает белый осадок сульфата свинца. Осадок делят на две части, помещая их в две разные пробирки. К одной части прибавляют раствор щелочи, к другой - 30 % раствор ацетата аммония. Осадок растворяется в обоих случаях.
Реакция сродизонатом натрия Na2C6O6. Катионы свинца образуют с органическим реагентом - родизонатом натрия
окрашенный комплекс синего цвета (по-видимому, состава Pb3(C6O6)2(OH)2), который в слабокислой среде (рН = 2,8; тартратный буферный раствор) изменяет окраску на красную.
Реакция высокочувствительна: определяемый минимум равен 0,1 мкг, предельная концентрация - 2 10-6 г/мл, предельное разбавление - 5 105 мл/г. Позволяет открывать катионы свинца даже при очень низких концентрациях.
Реакцию обычно проводят капельным методом на фильтровальной бумаге. Мешают катионы Ag+,Cd2+,Sr2+,Ba2+,Tl+, Sn(II).
Методика. На лист фильтровальной бумаги наносят каплю раствора Pb(NO3)2 и каплю свежеприготовленного 0,2 % раствора родизоната натрия. Образуется синее пятно или кольцо. На пятно наносят каплю тартратного буферного раствора. Цвет пятна изменяется на красный.
Тартратный буферный раствор при рН = 2,8 готовят из расчета того, чтобы 1 мл раствора содержал 0,019 г гидротартрата натрия и 0,015 г винной кислоты.
Реакция с сульфид-ионами (фармакопейная). Катионы свинца при реакции с сульфид-ионами S2- образуют черный осадок сульфида свинца PbS:
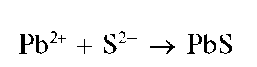
Осадок растворяется в азотной кислоте.
Методика. В пробирку вносят 2-3 капли раствора соли свинца(II) и прибавляют 2-3 капли раствора сульфида натрия Na2S или сероводородной воды. Выпадает черный осадок сульфида свинца PbS.
Другие реакции катионов свинца. Катионы свинца образуют осадки при реакциях: с водным аммиаком - основные соли белого цвета (например, PbOHCl); с молибдатом аммония (NH4)2MoO4 - белый PbMoO4;с K4[Fe(CN)6] - белый ферроцианид свинца Pb2[Fe(CN)6]; c Na2HPO4 - белый Pb3(PO4)2 и с рядом других соединений.
Очень чувствительна реакция катионов свинца с органическим реагентом - дитизоном. При смешивании хлороформного раствора дити-зона с водным раствором соли свинца образуется красный дитизонат-ный комплекс свинца, экстрагирующийся из водной фазы в органическую и окрашивающий слой хлороформа в красный цвет. Предел обнаружения составляет 0,04 мкг.
Мешают катионы Cu2+,Ag+,Zn2+ и некоторые другие.
Катионы свинца образуют комплексы и с другими органическими реагентами.