V аналитическая группа: Mg2+,Sb3+,Sb5+,Bi3+,Mn2+,Fe2+,Fe3+
При действии группового реагента (водного раствора щелочи или аммиака) катионы пятой аналитической группы осаждаются из водного раствора в виде гидроксидов Mg(OH)2,Mn(OH)2,Fe(OH)2,Fe(OH)3, Sb(OH)3,SbO(OH)3,Bi(OH)3Гидроксиды катионов пятой аналитической группы не растворяются в избытке группового реагента, в отличие от катионов четвертой аналитической группы.
На воздухе гидроксиды марганца(II) и железа(II) постепенно окисляются кислородом:
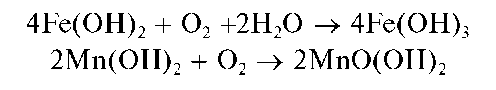
При действии группового реагента в присутствии пероксида водорода происходит окисление железа(II) до железа(III), марганца(II) - до марганца(IV), сурьмы(III) - до сурьмы(V):
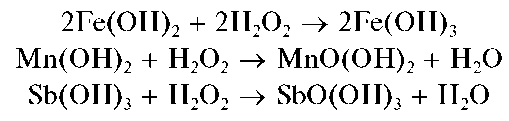
Методика.
а) В 6 пробирок помещают по нескольку капель растворов солей магния, марганца(II), железа(II), железа(III), сурьмы(III) и висмута(III), добавляют по 3-4 капли воды и по каплям раствор натрия гидроксида до выделения осадка. Обращают внимание на цвет осадков. Осадки отделяют от раствора центрифугированием и проверяют растворимость в азотной кислоте и в концентрированном растворе аммиака.
Осадки магния и марганца(II) гидроксидов дополнительно проверяют на растворимость в насыщенном растворе аммония хлорида.
б) К осадкам железа(II) и марганца(II) гидроксидов добавляют по 2-3 капли разбавленного раствора натрия гидроксида и водорода пероксида. Наблюдают за изменением цвета осадков. Проверяют растворимость полученного черно-бурого осадка MnO(OH)2 в насыщенном растворе хлорида аммония и разбавленной азотной кислоте.
Аналитические реакции катиона магния Mg2+
Реакции с щелочами и аммиаком. Катионы Mg2+ придействии щелочей и аммиака образуют белый аморфный осадок гидроксида магния Mg(OH)2
: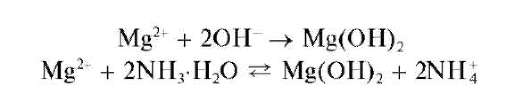
При реакции с аммиаком достигается неполное осаждение катионов Mg2+ в виде Mg(OH)2, так как гидроксид магния частично растворяется в растворах солей аммония (особенно в концентрированных) вследствие смещения последнего равновесия влево при увеличении концентрации катионов аммония.
Осадок Mg(OH)2 не растворяется в щелочах, но растворяется в кислотах:
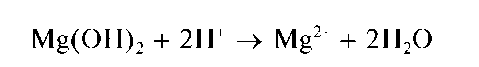
Методика. В две пробирки вносят по 5-6 капель раствора соли магния и прибавляют по каплям: в одну - раствор NaOH, в другую - раствор аммиака до выпадения белого аморфного осадка.
Реакция с гидрофосфатом натрия (фармакопейная). Катионы Mg2+ образуют с гидрофосфатом натрия в присутствии катионов аммония и аммиака (аммиачный буфер) белый мелкокристаллический осадок магнийаммонийфосфата NH4MgPO4:

При проведении реакции катионов Mg2+ с гидрофосфатом натрия в отсутствии катионов аммония и аммиака выпадает белый аморфный осадок гидрофосфата магния MgHPO4.
Осадок магнийаммонийфосфата растворяется в минеральных кислотах и в уксусной кислоте:
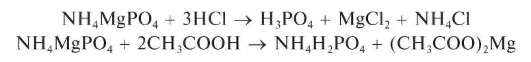
Реакция образования NH4MgPO4 достаточно чувствительна: предел обнаружения ~0,010 мкг (подругимданным - около10 мкг), предельное разбавление - 8,3 104 мл/г. Мешают катионы Li+,Ca2+,Sr2+,Ba2+ и другие, дающие малорастворимые фосфаты.
Реакцию можно проводить как микрокристаллоскопическую.
Методика.
Первый вариант. В пробирку вносят 2-3 капли раствора соли магния, прибавляют по 1-2 капли растворов NH4Cl, аммиака и Na2HPO4. Раствор мутнеет и образуется белый осадок NH4MgPO4.
Второй вариант. В пробирку вносят по одной капле растворов соли магния, NH4Cl и концентрированного аммиака. Каплю смеси наносят на предметное стекло и рядом помещают каплю раствора Na2HPO4 Приводят капли в соприкосновение и через 1-3 мин наблюдают под микроскопом образование прозрачных бесцветных кристаллов магнийаммонийфосфата.
Реакция с магнезоном 1 - п-нитробензолазорезорцином.В щелочной среде магнезон-I, имеющий красную окраску, образует с катионами Mg2+ комплекс синего цвета, сорбирующийся на осадке гидроксида магния. Предположительно реакцию можно описать схемой:
В этой схеме показано строение фрагмента образующегося комплекса. С атомом магния(II) связаны, по-видимому, и другие лиганды (например, молекулы воды), поскольку координационное число 3 для магния(II) нехарактерно.
Реакция высокочувствительна: предел обнаружения - 0,5 мкг. Мешают многие катионы (Cd2+,Sn2+,Cr3+,Fe2+,Co2+,Ni2+ и др.), также образующие окрашенные комплексы с магнезоном.
Методика. На предметное стекло наносят каплю раствора соли магния и прибавляют каплю щелочного раствора магнезона. Образует-
ся синий осадок. При малых концентрациях катиона магния осадок не выделяется, а раствор окрашивается в синий цвет.
Реакция с 8-оксихинолином. Катионы Mg2+ образуют с 8-оксихинолином в аммиачной среде при рН = 8-13 (лучше - при нагревании) желто-зеленый кристаллический осадок внутрикомплексного соединения - оксихинолината магния:
Осадок оксихинолината магния растворим в минеральных кислотах и в уксусной кислоте.
Реакция высокочувствительна: предел обнаружения - 0,25 мкг. Мешают катионы, также образующие комплексы с 8-оксихинолином (Cu2+,Zn2+,Cd2+,Fe3+ и др.).
Методика. В пробирку вносят 2- 3 капли раствора хлорида магния, 2 капли раствора аммиака и прибавляют по каплям раствор хлорида аммония до растворения первоначально выпавшего белого осадка гид-роксида магния Mg(OH)2. К раствору прибавляют по каплям раствор 8-оксихинолина до выпадения желто-зеленого осадка оксихинолината магния.
Реакция с хинализарином. Катион Mg2+ при взаимодействии с хинализарином в щелочной среде дает синий осадок комплексного соединения - хинализарината магния состава MgL(OH), где HL - условное обозначение молекулы хинализарина:
Строение комплекса точно неизвестно. Раствор самого хинализарина в щелочной среде имеет фиолетовую окраску.
При небольшом содержании катионов магния в растворе осадок не выпадает, а раствор окрашивается в васильково-синий цвет.
Реакция высокочувствительна: предел обнаружения - 0,25 мкг. Мешают катионы алюминия.
Методика. В пробирку вносят 3- 4 капли раствора MgCl2,2-3 капли спиртового раствора хинализарина и 2- 3 капли раствора NaOH. Выпадает синий осадок хинализарината магния, а раствор окрашивается в васильково-синий цвет.
Другие реакции катионов магния. Катионы Mg2+ образуют с оксала-том аммония (NH4)2C2O4 белый осадок оксалата магния MgC2O4, фенилкарбазидом (C6H5NHNH)2CO - комплекс красно-фиолетового цвета. Свежевыпавший осадок Mg(OH)2 при взаимодействии с гипой-одитом калия KiO (или гипойодидом натрия NaiO) окрашивается в красно-бурый цвет вследствие сорбции йода на поверхности гидро-ксида магния. Катионы магния взаимодействуют также с другими реагентами с образованием продуктов различного состава.
Аналитические реакции сурьмы(III) и сурьмы(V)
Соли сурьмы(III) и сурьмы(V) гидролизуются в водных растворах с образованием осадков малорастворимых основных солей сурьмы. Поэтому обычно используют кислые растворы сурьмы(III) и сурьмы(V), в которых их гидролиз подавляется и образуются соответствующие ацидокомплексы. Так, в концентрированных растворах HO присутствуют ацидокомплексы [SbCl4]- или [SbCl6]- .
Соединения сурьмы окрашивают пламя газовой горелки в голубой цвет.
Аналитические реакции сурьмы(III)
Реакции с щелочами и раствором аммиака. При прибавлении раствора щелочи или аммиака к раствору, содержащему сурьму(III), выпадает белый осадок гидроксида сурьмы(III) Sb(OH)3 (который можно также представить как сурьмяную кислоту H3SbO3 или HSbO2*H2O):
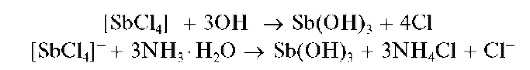
Свежевыпавший осадок Sb(OH)3 растворяется в избытке щелочи с образованием гидроксокомплексов [Sb(OH)4]-:
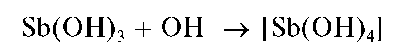
Осадок Sb(OH)3 растворяется также и в кислотах с образованием ацидокомплексов:
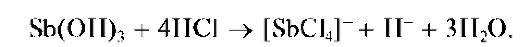
Придействиищелочивприсутствиипероксида водорода H2O2 сурьма(III) окисляется до сурьмы(V), давая белый осадок SbO(OH)3:
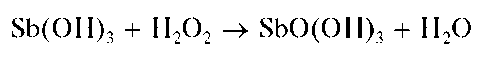
Методика. В пробирку вносят 3-4 капли солянокислого раствора сурьмы(III), прибавляют 3- 4 капли дистиллированной воды и затем по каплям - раствор NaOH до выпадения белого осадка Sb(OH)3. Продолжают прибавление по каплям раствора NaOH при перемешивании содержимого пробирки до растворения выпавшего осадка.
Реакция гидролиза. Разбавление водой растворов, содержащих сурьму(III), приводит к ее гидролизу. Так, при добавлении воды к солянокислому раствору сурьмы(III) гидролиз идет (при рН = 3-4) с выделением белого осадка малорастворимого оксохлорида сурьмы(III) состава SbOCl:
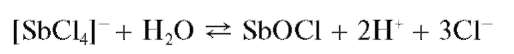
Свежевыпавший осадок оксохлорида сурьмы растворяется (лучше - при нагревании) в растворах HO, винной кислоты H2C4H4O6 иее солей:
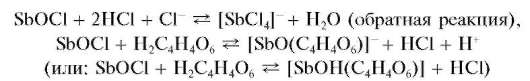
Методика. В пробирку вносят 2- 3 капли солянокислого раствора хлорида сурьмы(III) и прибавляют по каплям воду до образования белого хлопьевидного осадка SbOCl.
Реакция с сульфид-ионами. Сульфид-ионы S2- в кислой среде осаждают из растворов сурьмы(III) оранжевый осадок сульфида сурьмы(III) Sb2S3:
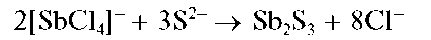
При избытке сульфид-ионов осадок растворяется с образованием тиосоли, содержащей анион SbS3-:
Осадок сульфида сурьмы(III) растворяется также в концентрированной HO при нагревании, в растворах щелочей:
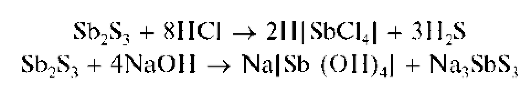
Методика. В пробирку вносят 3 капли солянокислого раствора хлорида сурьмы(III), 2 капли концентрированной HO и прибавляют по каплям раствор сульфида аммония (NH4)2S (или сульфида натрия Na2S) или сероводородную воду. Выпадает оранжевый осадок сульфида сурьмы(III).
Реакция с тиосульфатом натрия. Прибавление раствора тиосульфата натрия Na2S2O3 к кислому раствору сурьмы(III) приводит к образованию красного осадка «сурьмяной киновари» состава Sb2OS2:
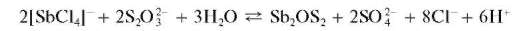
Ранее полагали, что этот осадок представляет собой смесь Sb2S3 и Sb2O3 Мешает висмут(III), образующий черный осадок.
Методика. В пробирку вносят 3-4 капли солянокислого раствора хлорида сурьмы(III) и прибавляют 2-3 капли раствора тиосульфата натрия. Выпадает красный осадок.
Реакции восстановления сурьмы(III) до сурьмы(0). Сурьма(III) восстанавливается до металлической сурьмы в кислой среде металлическими магнием, алюминием, цинком, оловом, железом, например:
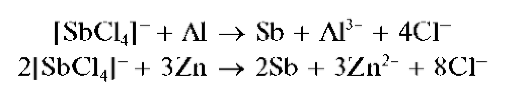
Металлическая сурьма выделяется в виде черного осадка на поверхности металла.
Методика. В пробирку вносят несколько капель солянокислого раствора хлорида сурьмы(III) и кусочек металлического алюминия или цинка, либо железа. Поверхность металла чернеет вследствие выделения хлопьевидного осадка свободной сурьмы.
Другие реакции сурьмы(III). При взаимодействии сурьмы(III) с фосфорномолибденовой гетерополикислотой образуется продукт реакции синего цвета - «молибденовая синь», экстрагируемый амиловым спиртом.
С метилфлуороном C13H4O2(OH)3CH3 сурьма(III) в присутствии H2O2 и HCl дает продукт красного цвета (капельная реакция на фильтровальной бумаге); реакция специфична для сурьмы(III).
Такие окислители, как KMnO4,K2Cr2O7,KBrO3 и другие, окисляют в растворах сурьму(III) до сурьмы(V).
Известен и ряд других реакций сурьмы(III).
Аналитические реакции сурьмы(V)
Реакция с щелочами и аммиаком. Сурьма(V) образует с гидроксида-ми щелочных металлов и аммиаком белый осадок состава SbO(OH)3:
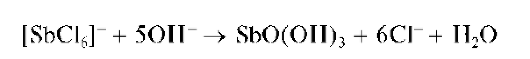
Свежевыпавший осадок SbO(OH)3 растворяется в избытке щелочи и в сильных кислотах:
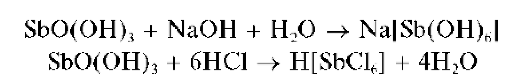
Методика. В пробирку вносят несколько капель солянокислого раствора сурьмы(V) и прибавляют по каплям раствор NaOH до выпадения белого осадка SbO(OH)3 При дальнейшем прибавлении раствора щелочи осадок растворяется.
Реакция гидролиза. При разбавлении водой растворов сурьмы(V) последняя гидролизуется с образованием основных солей. Так, при прибавлении воды к солянокислому раствору сурьмы(У) гидролиз идет до образования белого осадка оксохлорида сурьмы(V) состава SbO2Cl:
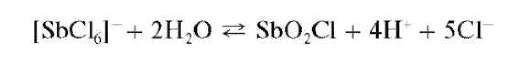
Осадок SbO2Cl растворяется в избытке HCl (обратная реакция) и в растворах винной кислоты и ее солей.
Методика. В пробирку вносят 2-3 капли солянокислого раствора сурьмы(V) и по каплям прибавляют дистиллированную воду до выпадения белого осадка SbO2Cl.
Реакция с сульфид-ионами. При реакции с сульфид-ионами в кислой среде сурьма(V) образует оранжевый осадок сульфида сурьмы(V) Sb2S5:
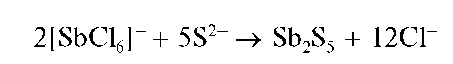
При избытке сульфид-ионов осадок растворяется с образованием тиосолей:
Осадок Sb2S5 растворяется в щелочах:
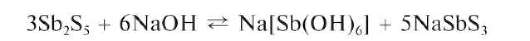
В концентрированной HCl при нагревании сульфид сурьмы(У) растворяется с выделением свободной серы и восстановлением сурьмы(У) до сурьмы(III):

Методика. В пробирку вносят ~3 капли солянокислого раствора сурьмы(V), 2 капли концентрированной HCl и прибавляют по каплям раствор сульфида аммония (NH4)2S (или сульфида натрия Na2S) либо сероводородную воду. Выпадает оранжевый осадок Sb2S5. Прибавление избытка реагента приводит к растворению осадка.
Реакции восстановления сурьмы(V) до сурьмы(0). Сурьма(V как и сурьма(III), восстанавливается в кислой среде металлическим магнием, цинком, алюминием, оловом, железом до свободной сурьмы(0). Условия проведения реакций восстановления сурьмы(V) аналогичны условиям проведения реакций восстановления сурьмы(III) (см. выше).
Реакция с родамином Б. Сурьма(У) в солянокислых растворах реагирует с органическим реагентом - родамином Б (условно обозначим его как L+Cl-):
с образованием фиолетового или сине-фиолетового соединения (ионного ассоциата) состава L+[SbCl6]- :
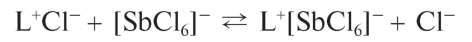
Образовавшийся ионный ассоциат экстрагируется из водной фазы бензолом или изопропанолом; при этом органический слой окрашивается в фиолетово-синий цвет.
Если в растворе присутствует не сурьма(V), а сурьма(III), то предварительно сурьму(III) окисляют нитритом натрия NaNO2 до сурьмы(V), после чего сурьму(V) открывают реакцией с родамином Б.
Методика. В пробирку вносят 3-4 капли солянокислого раствора сурьмы(V), прибавляют 2-3 капли концентрированной HC1, ~1 мл дистиллированной воды, 3-4 капли раствора родамина Б (обычно 0,06 %) и 5-6 капель бензола. Встряхивают смесь. Органический (бензольный) слой окрашивается в фиолетово-синий цвет.
В случае присутствия в растворе сурьмы(III) реакцию проводят аналогично, за исключением того, что после прибавления концентрированной HCl в пробирку добавляют дополнительно 2-3 капли раствора нитрита натрия.
Другие реакции сурьмы(V). Сурьма(V) в солянокислых растворах (в форме [SbCl6]-) реагирует с органическим реагентом метилфиолетовым, с йодидами и некоторыми другими соединениями. С метилфио-летовым образуется тонкая суспензия малорастворимого соединения синего цвета. Йодидами сурьма(У) восстанавливается до сурьмы(III). При этом реакционная смесь принимает бурую окраску за счет выделения йода I2.
Аналитические реакции висмута(III)
Соли висмута(Ш) гидролизуются в водных растворах с образованием осадков малорастворимых оксосоединений - солей висмути-ла, формально содержащих катион висмутила BiO+ (например, BiOC1, BiONO3 и др.). Если соль висмута(III) растворить в воде, то получают мутный раствор вследствие образования частиц продуктов гидролиза. Для подавления гидролиза и получения прозрачных растворов соль висмута(III) растворяют не в чистой воде, а в растворах кислот, чаще всего - в растворе HCl, в котором висмут(III) присутствует в форме хлоридных комплексов [BiC16]3- . На практике обычно используют солянокислые растворы хлорида висмута(III).
Реакции с щелочами и аммиаком. При прибавлении растворов щелочей или аммиака к раствору соли висмута(III) выпадает белый осадок гидроксида Bi(OH)3:
Осадок растворяется в минеральных кислотах. При нагревании белый осадок Bi(OH)3 желтеет вследствие образования оксогидроксида висмута(III) BiO(OH) (гидроксида висмутила):
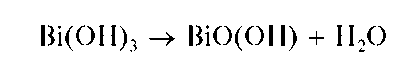
Методика. В пробирку вносят несколько капель солянокислого раствора хлорида висмута(III) и прибавляют по каплям раствор NaOH до выпадения белого осадка Bi(OH)3.
Реакция гидролиза. Разбавление водой растворов солей висмута(Ш) приводит к их гидролизу с выделением белого осадка оксохлорида висмута BiOCl (хлорида висмутила):
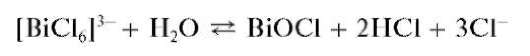
При прибавлении раствора HO и нагревании осадок растворяется (обратная реакция). В отличие от оксохлоридов сурьмы, осадок оксохлорида висмута(III) не растворяется в растворах винной кислоты и ее солей.
Методика. К 2-3 каплям солянокислого раствора хлорида висму-та(Ш) в пробирке прибавляют по каплям воду до выпадения белого осадка BiOCl.
Реакция с сульфид-ионами (фармакопейная). Висмут(III) при реакции с сульфид-ионами в кислой среде образует черно-коричневый осадок сульфида висмута(III) Bi2S3:
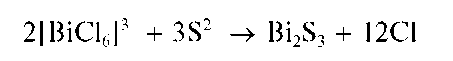
Осадок не растворяется в разбавленных минеральных кислотах, за исключением разбавленной HNO3, в которой он растворяется с выделением свободной серы:
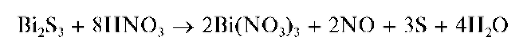
Осадок сульфида висмута растворяется в присутствии хлорида железа(III) FeCl3 - также с выделением свободной серы:
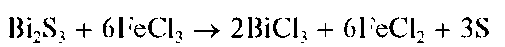
Методика. В пробирку вносят 3- 4 капли солянокислого раствора хлорида висмута(III) и прибавляют по каплям раствор (NH4)2S, или Na2S, или сероводородной воды. Выпадает черно-коричневый осадок сульфида висмута Bi2S3.
Реакция с иодидами (фармакопейная). При прибавлении растворов иодидов к кислым растворам висмута(III) выпадает черный осадок иодида висмута(III) BiI3, растворимый в избытке реагента с образованием желто-оранжевого раствора, содержащего тетраиодовисмутат(III)-ионы [BiI4] -:
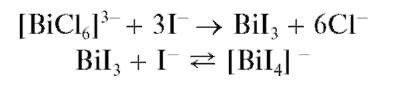
Разбавление полученного раствора водой приводит к выпадению осадка BiI3 с последующим его гидролизом и образованием желто-оранжевого оксоиодида висмута BiOI (иодида висмутила). Суммарно реакцию гидролиза можно описать схемой:
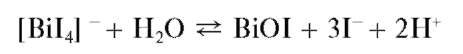
Методика. В пробирку вносят около 5 капель солянокислого раствора хлорида висмута(Ш) и прибавляют по каплям раствор KI до выпадения черного осадка йодида висмута(Ш). Дальнейшее прибавление избытка раствора KI приводит к растворению осадка и образованию оранжевого раствора. При прибавлении воды к этому раствору и его нагревании образуется оранжевый осадок йодида висмутила BiOI.
Реакция восстановления висмута(III) до висмута(О) соединениями олова(II). В щелочной среде (рН = 10) олово(11) восстанавливает висмут(III) до металлического висмута(О), выделяющегося в виде черного осадка. Олово(II) при этом окисляется до олова(IV):
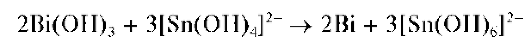
При большом избытке щелочи и нагревании выпадает также черный осадок металлического олова вследствие протекания реакции диспропорционирования:
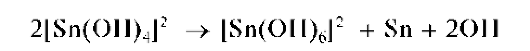
При недостатке щелочи может выпасть черный осадок оксида олова(II) SnO:
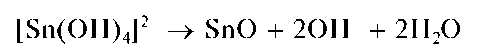
Методика. В пробирку вносят 2 капли солянокислого раствора хлорида олова(II), 8-10 капель 2 моль/л раствора NaOH до растворения первоначально выпавшего осадка Sn(OH)2 и добавляют 1-2 капли раствора соли висмута(III). Выпадает осадок черного цвета - металлический висмут.
Реакция с тиокарбамидом (тиомочевиной). Висмут(III) при взаимодействии с тиокарбамидом SC(NH2)2 в кислой среде образует растворимый комплекс желтого цвета состава [BiL3]3+, где L - условное обозначение молекулы тиокарбамида:
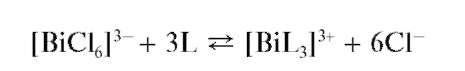
Мешают катионы Hg22+,Fe3+.
Методика. На предметное стекло наносят каплю солянокислого раствора хлорида висмута(Ш) и добавляют кристаллик тиокарбамида. Капля окрашивается в оранжевый цвет.
Другие реакции висмута(III). Известно большое число (несколько десятков) реакций висмута(III), которые могут иметь аналитическое значение. Так, с тиосульфатом натрия при нагревании выделяется осадок сульфида висмута Bi2S3; с гидрофосфатом натрия Na2HPO4 - белый осадок фосфата висмута BiPO4; c дихроматами - желтый осадок дихромата висмутила (BiO)2Cr2O7; с 8-оксихинолином и KI - оранжево-красный осадок комплексного соединения - и т.д.
Аналитические реакции катиона марганца(II) Mn2+
Аквокомплексы [Mn(H2O)6]2+ марганца(II) окрашены в бледно-розовый цвет, поэтому водные растворы солей марганца(II) при достаточно больших концентрациях имеют бледно-розовую окраску. Сильно разбавленные водные растворы солей марганца(II) практически бесцветны.
Реакции с щелочами и аммиаком. При прибавлении растворов щелочей или аммиака к растворам, содержащим катионы Mn2+, выпадает белый осадок гидроксида марганца(II) состава Mn(OH)2:
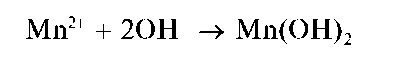
При стоянии осадок буреет за счет окисления кислородом воздуха до черно-коричневого оксогидроксида марганца(IV) состава MnO(OH)2 (H2MnO3):
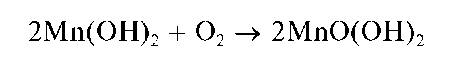
При действии щелочей на растворы солей марганца(II) в присутствии пероксида водорода образующийся вначале гидроксид марганца(II) Mn(OH)2 окисляется пероксидом водорода до черно-коричневого MnO(OH)2:
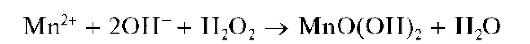
Осадок Mn(OH)2 растворяется в разбавленных растворах сильных кислот и в насыщенном растворе хлорида аммония:
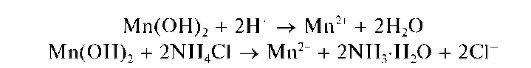
Осадок MnO(OH)2 не растворяется при действии этих реагентов.
Методика.
а) В пробирку вносят 3-4 капли раствора соли марганца(II) и прибавляют по каплям раствор NaOH до прекращения выпадения белого осадка Mn(OH)2 При стоянии осадок темнеет вследствие образования
MnO(OH)2
б) К свежевыпавшему осадку Mn(OH)2, полученному, как описано выше, прибавляют по 3-4 капли растворов NaOH и H2O2Белый осадок Mn(OH)2 переходит в черно-коричневый MnO(OH)2.
Реакции окисления катионов Mn2+ до перманганат-ионов. Катионы Mn2+ под действием различных окислителей окисляются до перманганат-ионов MnO4-, окрашивающих раствор в малиново-фиолетовый цвет. В качестве окислителей применяют висмутат натрия NaBiO3, персульфат аммония (NH4)2S2O8, диоксид свинца PbO2 и др. Чаще всего используют висмутат натрия. Реакцию окисления катионов Mn2+ до MnO4- используют для открытия этих катионов в растворе.
Реакции окисления проводят в отсутствие хлорид-ионов Cl- , так как они восстанавливаются перманганат-ионами до хлора Cl2:
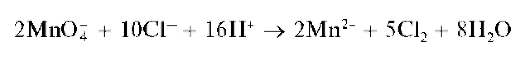
а) Окисление висмутатом натрия в кислой среде протекает по схеме:
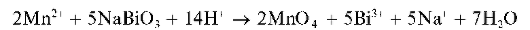
Избыток висмутата натрия может маскировать окраску раствора.
Методика. В пробирку вносят ~5 капель концентрированной HNO3, несколько крупинок висмутата натрия. Смесь перемешивают и прибавляют к ней 1-2 капли раствора сульфата MnSO4 или нитрата Mn(NO3)2 марганца(II) (но не хлорида MnCl2!). Раствор окрашивается в малиново-фиолетовый цвет.
б) Окисление персульфатом аммония. Реакцию проводят в кислой среде в присутствии катализатора - солей серебра (AgNO3)при нагревании: 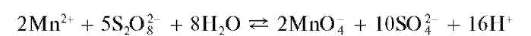
В качестве катализатора применяют также соли кобальта и меди.
В горячем растворе возможно разложение перманганат-ионов, которое замедляется в присутствии фосфорной кислоты H3PO4.
Методика. В пробирку вносят несколько кристалликов (NH4)2S2O8 (или ~0,5 мл насыщенного раствора (NH4)2S2O8), прибавляют ~2 мл раствора HNO3 (или H2SO4), 2- 3 капли раствора AgNO3 и 1-2 капли концентрированного раствора H3PO4 Нагревают смесь до кипения и прибавляют каплю раствора соли марганца(II). Раствор окрашивается в малиновый цвет.
в) Окисление диоксидом свинца в кислой среде при нагревании:
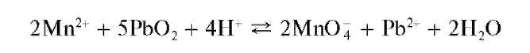
При избытке соли марганца(II) образуется MnO(OH)2, а не перманганат-ион.
Методика. В пробирку вносят небольшое количество PbO2 и прибавляют ~1 мл раствора HNO3. Смесь нагревают до кипения, прибавляют каплю раствора сульфата или нитрата марганца(П) и опять нагревают до кипения. Раствор окрашивается в малиновый цвет.
Реакция с сульфид-ионами. Катионы Mn2+ с сульфид-ионамиS2- образуют осадок сульфида марганца(II) MnS розовато-телесного цвета
: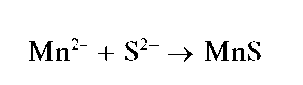
Осадок растворяется в разбавленных кислотах.
Методика. В пробирку вносят 3-4 капли раствора соли марганца(II) и прибавляют 1-2 капли раствора сульфида аммония (NH4)2S (или сульфида натрия Na2S) или сероводородной воды. Выпадает осадок сульфида марганца(II) телесно-розового цвета.
Другие реакции марганца(II). Катионы Mn2+ образуют с аммиакатом серебра [Ag(NH3)2]+ смесь MnO(OH)2 и металлического серебра буро-черного цвета:
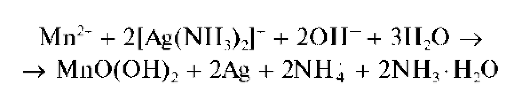
Реакцию можно проводить капельным методом на фильтровальной бумаге (наблюдается образование черно-бурого пятна).
Катионы Mn2+ дают ряд других реакций, представляющих меньший аналитический интерес.
Аналитические реакции катиона железа(II) Fe2+
Аква-ионы железа(II) [Fe(H2O)6]2+ практически бесцветны, поэтому растворы солей железа(II) обычно не окрашены.
Реакции с щелочами и аммиаком. Катионы Fe2+ образуют с щелочами и аммиаком белый осадок гидроксида железа(II) Fe(OH)2:
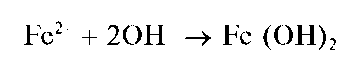
Гидроксид Fe(OH)2 растворяется в кислотах, но не растворяется в щелочах. При стоянии на воздухе гидроксид железа(II) Fe(OH)2 постепенно темнеет вследствие окисления железа(II) до железа(III) кислородом воздуха и образования красно-бурого гидроксида железа(III) Fe(OH)3:
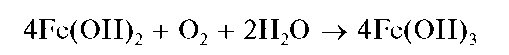
При действии щелочей на растворы солей железа(II) в присутствии пероксида водорода сразу образуется красно-бурый осадок Fe(OH)3 гидроксида железа(III):
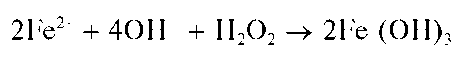
Методика
а) В пробирку вносят 5-6 капель раствора соли железа(II) и по каплям прибавляют раствор NaOH до прекращения выпадения белого осадка Fe(OH)2 На воздухе осадок постепенно темнеет.
б) К свежеприготовленному, как описано выше, белому осадку Fe(OH)2 прибавляют по 2-3 капли растворов NaOH и H2O2Окраска осадка изменяется до красно-бурой.
Реакция с гексацианоферратом(III) калия - феррицианидом калия (фармакопейная). Катионы Fe2+ реагируют с феррицианидом калия K3[Fe(CN)6] в кислой среде с образованием темно-синего осадка турнбулевой сини. Ранее полагали, что состав этого осадка соответствует формуле Fe3[Fe(CN)6]xH2O с переменным количеством молекул воды, причем, в зависимости от условий осаждения, состав осадка изменяется и может соответствовать, напрмер, формуле KFeII[FeIII(CN)6]xH2O при избытке катионов калия в растворе. Однако позднее было показано, что уже при образовании этого осадка осуществляется окислительно-восстановительный процесс с переносом электрона от «внешнесферного» железа(II) к внутрисферному железу(III):
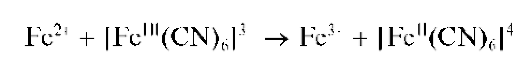
Образующиеся катионы Fe3+ и анионы [FeII(CN)6]4-дают темно-синий осадок конечного продукта состава Fe4III[FeII(CN)6]3xH2O, названный «турнбулевой синью»:
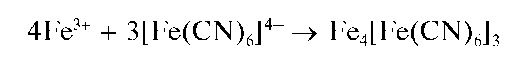
Суммарное уравнение реакции:
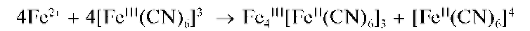
По составу, структуре и свойствам осадок турнбулевой сини идентичен осадку берлинской лазури, получаемому при прибавлении раствора ферроцианида калия K4[Fe(CN)6] к растворам солей железа(III).
Реакция очень чу